Im Alltag unterscheiden wir bei Löslichkeiten zwischen wasser- und fettlöslich. Wenn man die Struktur der Moleküle, Ionen, … auf Teilchenebene betrachtet, fällt auf, dass es mit den Polaritäten zusammenhängt.
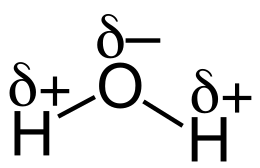
Die Polarität lässt sich an einem Wasser-Molekül gut erklären:

Das Sauerstoff-Atom zieht die Elektronen in der chemischen Bindung stärker an sich, als die Wasserstoff-Atome. Das liegt daran, dass Sauerstoff-Atome die größere Elektronegativität besitzen. Dadurch entstehen positive Teilladungen (δ+) bei den Atomen mit geringerer Elektronegativität (Wasserstoff-Atomen) und negative Teilladungen (δ-) bei dem Atom mit der größeren Elektronegativität (Sauerstoff-Atom).
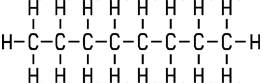
Unpolare Moleküle, wie zum Beispiel Octan, haben keine solchen Teilladungen, weil die Elektronen gleichmäßiger im Molekül verteilt sind. Die Elektronegativitätsunterschiede sind gering oder nicht vorhanden. Als Fausregel gilt: Je symmetrischer ein Molekül, desto unpolarer ist es.
Das Löslichkeitsverhalten von Farbstoffmolekülen wird stark durch das Vorhandensein von funktionellen Gruppen wie Hydroxygruppen und langen aliphatischen Ketten beeinflusst:
Hydroxygruppen (-OH) sind polar und können Wasserstoffbrückenbindungen mit Wasser-Molekülen eingehen. Dies erhöht die Polarität des Farbstoffmoleküls. Farbstoffemoleküle mit mehreren Hydroxygruppen lösen sich daher gut in polaren Lösungsmitteln wie Wasser. Lange aliphatische Ketten (Ketten aus Kohlenwasserstoffen) sind unpolar und hydrophob. Sie interagieren schlecht mit Wasser und lösen sich daher schlecht in polaren Lösungsmitteln wie Fetten oder Ölen.
Mit diesem Wissen könnt ihr die Forschung beginnen!

